|
|
|
|
Schema der Apparatur von Joule zur Bestimmung des mechanischen Wärmeäquivalents. Das Wasser ist gegen die Umgebung thermisch isoliert, so daß keine Wärme übertragen werden kann. Beim Herunterfallen der Massenstücke wird über die Seile die Walze gedreht, die mit dem Schaufelrad im Wasser fest verbunden ist. Vernachlässigt man die Reibung, dann ist die vom Schaufelrad auf das Wasser übertragene Arbeit gleich der Abnahme der potentiellen Energie der Massenstücke, die aus der Höhendifferenz und den Massen leicht zu berechnen ist.
Um zum ersten Hauptsatz zu gelangen, wiederholt man das Experiment von Joule, diesmal jedoch mit thermisch leitenden Behälterwänden. Dann zeigt sich, daß die Arbeit, die benötigt wird, um eine bestimmte Temperaturerhöhung des Systems zu erreichen, nicht konstant ist. Sie hängt nun davon ab, wieviel Wärme das System infolge Wärmeleitung durch die Wände abgibt. Mißt man beide Energien, die mit der Umgebung ausgetauschte Wärme und die aufgewandte, mechanische Arbeit, so sieht man, daß deren Summe bei derselben Temperaturdifferenz stets die gleiche ist.
Mit anderen Worten: Die Summe der Arbeit, die am System verrichtet wurde, und der von ihm abgeführten Wärme ist gleich der Änderung der inneren Energie des Systems. Dies entspricht der Aussage des ersten Hauptsatzes.
Bei der Kompression eines Gases wird eine mechanische
Arbeit W am System verrichtet, dessen innere Energie U sich dadurch
erhöht. Expandiert das Gas gegen den Atmosphärendruck, so gibt es Arbeit an
die Umgebung ab, und seine innere Energie wird geringer, die verrichtete Arbeit
ist dann ![]() . Die einem System
zugeführte Wärmemenge Q wird positiv gerechnet.
. Die einem System
zugeführte Wärmemenge Q wird positiv gerechnet.
Der Erste Hauptsatz der Thermodynamik lautet somit
![]()
üblicherweise so geschrieben:
![]()
Die dem System netto zugeführte Wärme Q ist die Differenz der Änderung seiner inneren Energie und der von ihm verrichteten Arbeit W.
Die innere Energie U eines Systems ist eine Zustandsfunktion. Das bedeutet, sie ist nur vom jeweiligen Zustand des Systems abhängig und nicht davon, auf welchem Wege dieser erreicht wurde. Im Unterschied dazu sind die verrichtete Arbeit und die umgesetzte Wärme keine Zustandsfunktionen. Man kann zwar sagen, ein System habe die innere Energie U, aber man kann ihm keinen bestimmten Inhalt an Arbeit oder Wärme zuschreiben. Dies sind genauer die möglichen Formen der Energie, die das System mit der Umgebung austauschen kann, wobei sich seine innere Energie, also sein Zustand, ändert.
Wichtig ist, daß Wärme nicht als solche im System enthalten ist, sondern die Form der Energie darstellt, die aufgrund einer Temperaturdifferenz vom System zur Umgebung und umgekehrt übergehen kann.
Gleitet zum Beispiel ein Klotz auf der rauhen Oberfläche einer schiefen Ebene herab, so geht seine kinetische Energie durch Reibung in Wärme über, die zur Erhöhung der inneren Energie des Klotzes und der Ebene führt. Niemals aber beobachtet man, den vom ersten Hauptsatz durchaus zugelassenen umgekehrten Prozeß, daß der Klotz aufwärts gleitet und dabei sich und die Ebene abkühlt. Daher ist die Umwandlung von kinetischer Energie in Wärme ein irreversibler Vorgang, d.h. er kann in der anderen Richtung nicht spontan ablaufen.
Wenn man zum Beispiel ein Gefäß mit hellem Sand nimmt und darauf eine Schicht dunklen Sand schüttet, so werden sich nach kräftigem Rütteln beide Sandsorten vermischt haben. Es gibt aber keine Methode, sie wieder zu entmischen, außer körnchenweisem Sortieren oder chemischer Trennung. Beides aber erfordert einen Energieaufwand.
Ein anderer irreversibler Prozeß ist die Wärmeleitung. Bringt man einen heißen Körper mit einem kalten in Kontakt, so fließt Wärme vom heißen zum kalten Körper, bis beide nach einer gewissen Zeit dieselbe Temperatur haben.
|
|
Das p-V-Diagramm für die adiabatische Expansion eines idealen Gases. Die gestrichelten Kurven sind die Isothermen der Anfangs- und der Endtemperatur. Die durchgezogene Kurve für die adiabatische Expansion verläuft steiler als die Isothermen, weil die Temperatur während dieses Vorganges abnimmt.
Es ist aber prinzipiell unmöglich, eine Wärmekraftmaschine
mit ![]() zu entwickeln. Das besagt
der zweite Hauptsatz der Thermodynamik in einer seiner möglichen Formulierungen,
auch das Prinzip von Thomson genannt. Es lautet:
zu entwickeln. Das besagt
der zweite Hauptsatz der Thermodynamik in einer seiner möglichen Formulierungen,
auch das Prinzip von Thomson genannt. Es lautet:
Es ist unmöglich, eine zyklisch arbeitende Wärmekraftmaschine zu konstruieren, die keinen anderen Effekt bewirkt, als Wärme aus einem Reservoir zu entnehmen und eine äquivalente Menge an Arbeit zu verrichten (Unmöglichkeit des „Perpetuum mobile“).
Entscheidend ist der Begriff zyklisch arbeitend. In einem nicht zyklischen Prozeß kann sehrwohl eine bestimmte Wärmemenge vollständig in Arbeit umgewandelt werden, beispielsweise durch isotherme Expansion eines idealen Gases. Aber danach hat das Gas nicht mehr denselben Zustand wie am Anfang und es muß Arbeit aufgewendet werden um wieder dahin zu gelangen.
Man kann nun die Bedingungen für die Reversibilität von Prozessen zusammenfassen:
1. Es darf keine mechanische Energie aufgrund von Reibung, viskosen Kräften oder anderen dissipativen (nicht rückgängig zu machenden) Effekten in Wärme umgesetzt werden.
2. Es darf keine Wärmeleitung aufgrund einer endlichen Temperaturdifferenz vorliegen.
3. Der Prozeß (und alle Teilvorgänge) müssen quasistatisch ablaufen, so daß sich das System stets im Gleichgewichtszustand oder in infinitesimaler Abweichung davon befindet.
Jeder Prozeß, der auch nur eine dieser Bedingungen nicht erfüllt, ist irreversibel. Dies ist bei den meisten natürlichen oder technischen Vorgängen der Fall.
Wenn aber keine Wärmekraftmaschine einen höheren
Wirkungsgrad als die reversibel arbeitende Maschine haben kann, dann müssen
alle reversiblen Maschinen, die zwischen denselben Wärmereservoirs arbeiten,
denselben Wirkungsgrad besitzen. Man nennt ihn den Carnot-Wirkungsgrad
![]() . Er ist dadurch gekennzeichnet, daß
er nicht von der Arbeitssubstanz, sondern ausschließlich von den Temperaturen
der Reservoirs abhängt.
. Er ist dadurch gekennzeichnet, daß
er nicht von der Arbeitssubstanz, sondern ausschließlich von den Temperaturen
der Reservoirs abhängt.
Bei einem reversiblen Prozeß ist die Entropieänderung des Universums gleich Null. Unter „Universum“ versteht man die Gesamtheit von System und Umgebung.
Bei einem irreversiblen Prozeß nimmt die Entropie des Universums zu.
Es gibt keinen Prozeß, durch den die Entropie des Universums abnimmt.
Durch jeden irreversiblen Prozeß wird eine bestimmte Energie entwertet, steht also nicht mehr zum Verrichten von Arbeit zur Verfügung. Diese Energie ist gleich dem Produkt aus der Entropieänderung des Universums und der absoluten Temperatur des kältesten vorhandenen Reservoirs.
![]()
Ein Zustand hoher Ordnung hat eine geringe Wahrscheinlichkeit, ein Zustand niedriger Ordnung dagegen eine hohe Wahrscheinlichkeit. Bei einem irreversiblen Prozeß geht das Universum in einen Zustand höherer Wahrscheinlichkeit über.
|
|
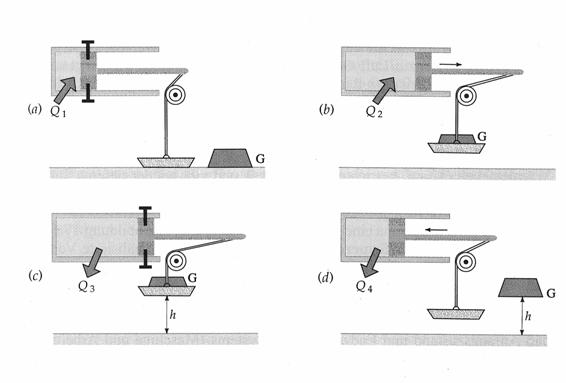
Der Kreisprozeß einer einfachen Wärmekraftmaschine. a) Bei konstantem Volumen (der Kolben wird festgehalten) wird das Gas erwärmt. Dabei steigt der Druck. Dann wird ein Massestück G auf die Schale gelegt b), so daß der Kolben im Gleichgewicht gehalten wird. Nach Loslassen des Kolbens wird bei konstantem Druck weitere Wärme zugeführt, das Gas expandiert und hebt die Masse an. c) Der Kolben wird wieder fixiert, während das Gas auf die Anfangstemperatur abgekühlt wird. d) Das Massestück und die Fixierung werden entfernt und das Gas wird bei konstantem Druck auf den Anfangszustand komprimiert. e) Das p-V-Diagramm des gesamten Prozesses. Im Schritt b) verrichtet das Gas Arbeit und im Schritt d) wird Arbeit am Gas verrichtet. Die vom Gas netto abgegebene Arbeit entspricht der getönten Fläche.
|
|
Beim Carnot-Kreisprozeß, hier für ein ideales Gas, werden alle Schritte reversibel durchgeführt. Während der isothermen Expansion von 1 nach 2 wird Wärme aufgenommen. Von 2 nach 3 wird adiabatisch expandiert, bis die Temperatur gesunken ist. Dann wird von 3 nach 4 isotherm komprimiert, wobei wieder Wärme abgegeben wird. Schließlich wird von 4 nach 1 adiabatisch komprimiert, bis wieder die Ausgangstemperatur erreicht ist.
In der Abbildung dient ein ideales Gas als Arbeitssubstanz. Die Schritte sind in der Bildlegende beschrieben und der reversibel durchgeführte Gesamtvorgang heißt Carnot-Kreisprozeß. Die vom Gas abgegebene Nettoarbeit entspricht der getönten Fläche im p-V-Diagramm.